Da Silizium und Sauerstoff die häufigsten Elemente und Siliziumdioxid (SiO2) das häufigste Mineral der Erdkruste ist, soll hier näher auf die vielfältigen Kombinationsmöglichkeiten des Silikats eingegangen werden.
Chemische Formeln der Silikate wirken selbst für den chemisch Bewanderten oft sehr kompliziert und abschreckend, da die Anzahl der in den Formeln angegebenen Atome oft sehr hoch ist und eine bildliche Vorstellung der Struktur dabei auch nicht möglich ist. Da Silikate jedoch im Prinzip meist sehr einfach gebaut sind, soll im folgenden der Versuch unternommen werden, einen grundsätzlichen und leicht fassbaren Eindruck vom Bau der Silikate zu vermitteln:
Der Name Kieselsäure für Quarz spiegelt die Eigenschaften des Silikats sehr gut wieder. Die Formel H4SiO4 für Kieselsäure entspricht nämlich einem gut vorstellbaren Grundbaustein der Silikate, wenn man die Wasserstoff-Ionen (H+) weg lässt. Dieser Baustein besteht aus einer 3 seitigen Pyramide, genau genommen einem SiO44--Tetraeder-Ion, bestehend aus einem zentralen Silizium-Atom (Si) und 4 Ecken aus je einem Sauerstoffatom (O). Die Grundfläche ist ein gleichseitiges Dreieck und die Kanten sind alle gleich lang.
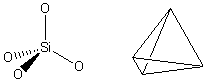
An jeder Ecke kann ein beliebiges Atom anknüpfen. Im wesentlichen sind alle Silikate durch Aneinanderreihung dieser SiO44- Pyramiden aufgebaut. Man kann sich das Kristallgerüst des Quarz (z.B. Bergkristall als Reinform) u. a. Silikate (unter Beteiligung anderer Atom) als Gerüst aus vielen solchen Pyramiden vorstellen (s. Gerüstsilikat-Struktur).
![von Actualist (Eigenes Werk) [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons von Actualist (Eigenes Werk) [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons](http://www.petrefaktum.de/wp-content/uploads/2015/08/SilikatstrukturenWikimActualist-133x300.png)
Silikatstrukturen
a) SiO4-Tetraeder
b) Gruppensilikat
c) Ringsilikat, Gruppensilikat
d) Kettensilikat
e) Bandsilikat
f) Schichtsilikat, Blattsilikat



